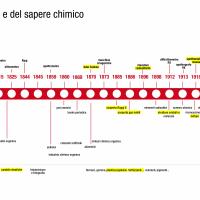
Stanislao Cannizzaro
Stanislao Cannizzaro è lo scienziato italiano che più ha contribuito allo sviluppo della chimica moderna. Il suo celebre Sunto di un Corso di Filosofia Chimica (1858) ha fornito le basi della teoria molecolare e il metodo sperimentale che permette di determinare correttamente i pesi atomici. Professore a Genova dal 1855 al 1861 egli ha dato un forte impulso all’ampliamento degli studi di Chimica presso questa Università, anche rinnovandola nelle strutture e arricchendola di strumentazioni all’avanguardia per i tempi. Cannizzaro ebbe un ruolo importante anche nell’attività pubblica, dapprima impegnandosi per l’affermazione della causa risorgimentale ed in seguito, dopo la nomina a senatore nel 1871, per lo sviluppo scientifico ed industriale del nostro paese.
Stanislao Cannizzaro nel 1849 è ospitato a Parigi da Chevreul alla fine di ottobre
"Mi recai a Parigi. Per mezzo di una lettera di Piria mi posi in relazione con Cahours. Egli mi procurò l’introduzione nel piccolo laboratorio di chimica di Chevreul annesso al grande anfiteatro del Giardino delle Piante, del quale laboratorio era preparatore Cloez. Ivi lavorai assiduamente da me solo e qualche volta in compagnia di Cloez; qualche volta assistetti alle esperienze che Fremy faceva nel laboratorio di Gay-Lussac, il quale comunicava per mezzo dell’anfiteatro con quello di Chevreul. Mi allontanavo dal laboratorio soltanto nei giorni e nelle ore delle lezioni di Regnault al collegio di Francia, che costantemente seguivo. In quel laboratorio feci lo studio della cianamide ed avevo già preparato una provvista di cloruro di cianogeno e diverse ammine col metodo allora recente di Wurtz, per continuare ed estendere quel lavoro."
Il vetro e la Soffieria
Il vetro è un materiale ampiamente utilizzato nel laboratorio chimico grazie ad alcune sue caratteristiche particolarmente adatte allo scopo:
• l’inerzia chimica per gran parte delle sostanze utilizzate
• la stabilità in un ampio intervallo di temperature
• la trasparenza che permette di osservare ciò che avviene durante una trasformazione chimica (cambiamenti di colore, passaggi di stato)
• la lavorabilità relativamente semplice che consente la realizzazione di oggetti di varie dimensioni e forme Per questi motivi il laboratorio chimico aveva generalmente annessa una soffieria utilizzata per la riparazione delle apparecchiature e la produzione delle strumentazioni più semplici. Il chimico inoltre ricorre all’opera di abili artigiani soffiatori per la costruzione di particolari strumentazioni talvolta anche molto complesse.
L’elemento n° 61: PROMEZIO (PROMETHIUM)
La caccia all’elemento 61 iniziò dopo il 1914 quando gli esperimenti di Moseley permisero di definire il numero atomico di tutti gli elementi conosciuti ed indicarono chiaramente che nella tabella periodica tra il Nd (n.a. 60) ed il Sm (n.a. 62) doveva essere inserito, come già ipotizzato nel 1902 da Bramer, un elemento non ancora individuato. Negli anni 20 si ebbero due rivendicazioni di scoperta dell’elemento con n.a. 61: una da parte di ricercatori italiani, che proposero il nome Florenzio, l’altra da ricercatori statunitensi che proposero il nome Illinium e, subito, tra i due gruppi di ricerca scoppiò un’aspra controversia per il riconoscimento del primato della scoperta.
Entrambe le rivendicazioni non furono accreditate perché non accompagnate dall’effettivo isolamento dell’elemento stesso. In seguito venne anche appurato che esse erano viziate da una errata interpretazione degli spettri osservati per frazioni estratte da minerali contenenti lantanidi. Più precisamente le righe assegnate all’elemento 61 erano dovute alla presenza di tracce di altri elementi (Ba, Br e Pt nel caso dell’illinium e Gd nel caso del florenzio).
Ancora nel 1938, una terza rivendicazione di scoperta, anch’essa non riconosciuta per l’assenza di prove chimiche, fu avanzata da ricercatori dell’Ohio che dichiararono di aver ottenuto l’elemento 61, da loro battezzato Cyclon, per bombardamento di Nd e Pr con particelle di vario tipo in un ciclotrone.
Nel 1942 la formazione dell’elemento 61 fu osservata anche da Emilio Segre per bombardamento nel ciclotrone dell’Università di California di terre rare preparate a Genova da Luigi Rolla. Finalmente nel 1947 venne comunicato che, grazie alle nuove tecniche di separazione con cromatografia a scambio ionico, presso il laboratorio Clinton di Oak Ridge erano state preparate quantità apprezzabili dell’ìsotopo 147 dell’elemento 61.
Il nome Clintonium, inizialmente proposto venne però cambiato, su suggerimento della moglie del capo dello stesso gruppo di ricerca, in Promethium, da Prometeo l’eroe della mitologia greca che rubò il fuoco agli dei per donarlo agli uomini. Questa lunga e complicata storia, al di là delle difficoltà inerenti la chimica dei lantanidi, è soprattutto dovuta alle peculiari proprietà del Pm che, nonostante il basso numero atomico, non possiede alcun isotopo sufficientemente stabile per essere sopravvissuto fino ad oggi dai tempi in cui la Terra si formò.
Poichè il Pm in piccola quantità si forma spontaneamente dall’Uranio per fissione, molti avanzarono l’ipotesi che l’elemento 61 potesse essere estratto da minerali uraniferi. Questa possibilità risulta comunque alquanto remota in quanto tutti i 35 isotopi noti del Pm sono radioattivi con tempi di dimezzamento molto brevi ed, in una tonnellata di minerale, la quantità dell’isotopo più longevo (145Pm, T1/2=17.7 anni) viene stimata essere appena 10-12 grammi.
Luigi Rolla ed un elemento mancato. Il Florenzio
Alla fine della I guerra mondiale, Luigi Rolla, un professore genovese di Chimica allora a Firenze, si occupava della misura dei potenziali di prima ionizzazione di vari elementi, tra cui quelli detti delle Terre Rare.
Questi elementi erano appunto rari e la loro separazione e purificazione con il metodo della cristallizzazione frazionata ed il controllo spettroscopico e roentgenografico della purezza richiedevano procedure lunghe e complesse.
A quel tempo era noto che un elemento non ancora scoperto (il 61) si situava tra il neodimio (numero atomico 60) ed il samario (numero atomico 62) elementi appartenenti al gruppo delle Terre Rare.
Alcuni dati spettroscopici raccolti da Rolla e dai suoi collaboratori sembravano indicare la presenza dell’elemento 61 nelle terre ceriche da loro ottenute a partire dalle sabbie monazifere brasiliane, contenenti anche gadolinio, cerio, neodimio e samario.
Per confermare la scoperta occorreva isolare il nuovo elemento ma per farlo non era sufficiente la monazite a disposizione. Nel frattempo Rolla, per cautelare l’eventuale scoperta, inviò all’Accademia dei Lincei (giugno 1924) un plico suggellato contenente i suoi risultati, nei quali compariva per la prima volta al mondo il nome da attribuire all’elemento di numero atomico 61: FLORENZIO (Florentium, di simbolo Fr) in onore della città di Firenze.
Alla vicenda del florenzio si appassionò un industriale genovese, Felice Bensa, che donò all’Università di Firenze un milione di lire (l’equivalente oggi di un milione di euro) per comprare una quantità sufficiente di sabbie monazifere e gli strumenti necessari all’isolamento dell’elemento 61.
Fu fatta arrivare a Firenze una grande quantità di monazite brasiliana, dalla quale fu estratta una tonnellata di “didimio” (miscuglio di più elementi delle terre rare contenenti praseodimio, neodimio e samario); su questo materiale, nell’autunno del 1925, iniziarono i lavori per l’isolamento dell’elemento mancante situato tra neodimio e samario.
Il primo piano del laboratorio di Chimica di via Capponi a Firenze assunse l’ aspetto di un laboratorio industriale tanto era il materiale che veniva trattato. Le capsule di porcellana usate per la cristallizzazione furono fatte costruire appositamente per lo scopo e le più grandi avevano 1 metro di diametro mentre gli imbuti buchner per la filtrazione avevano la capacità di 5 litri.
È importante sottolineare che, per successive cristallizzazioni frazionate (in totale ne furono fatte 56142), furono ottenute notevoli quantità di alcuni elementi delle terre rare (cerio, praseodimio, neodimio, samario e gadolinio) di una purezza (verificata per via spettroscopica) mai raggiunta prima. Tuttavia Rolla non riuscì ad isolare il florenzio!
Quasi contemporaneamente alcuni chimici statunitensi annunciarono la scoperta dell’elemento 61 che chiamarono ILLINIO dal nome dello stato dell’Illinois. Questa notizia ebbe grande rilievo negli ambienti accademici in tutti gli Stati Uniti, essendo l’illinio il primo elemento scoperto in questa nazione. Molte prime pagine dei giornali vi furono dedicate e l’eco della scoperta arrivò fino in Europa.
Luigi Rolla fu sorpreso dall’annuncio di quella scoperta. Egli si dimostrò ben intenzionato a rivendicare ciò che, secondo lui, gli spettava e mandò una lettera alla rivista Nature nella quale rivendicava la priorità della sua scoperta, facendo notare che il nome florenzio era stato citato ben 18 mesi prima che l’illinio vedesse la luce.
Quella che seguì fu una lunga diatriba accademica mirante a stabilire a chi dovesse andare la palma del vincitore.
Attribuire un simile riconoscimento all’uno o all’altro dei gruppi di ricerca non era facile, considerando che il prestigio in gioco non era solo dei singoli scienziati o delle rispettive università ma anche dei due paesi, Italia e USA, in nessuno dei quali, prima di allora, era stato scoperto un elemento.
Per conservare il suo primato Rolla avrebbe dovuto isolare per primo il nuovo elemento. Il lavoro si protrasse fino agli inizi degli anni ’40, quando ormai si capì che il florenzio non poteva essere estratto dai minerali perché, forse, contenuto in quantità troppo esigue.
Negli ultimi anni di permanenza di Rolla a Firenze si ebbero grandi cambiamenti nei mezzi chimici e fisici: gli esperimenti si complicavano, nascevano i primi acceleratori. Nel 1947 venne finalmente isolato, ottenendolo per fissione dell’uranio, l’elemento 61, che venne chiamato PROMEZIO.
Luigi Rolla si spense l’8 Novembre 1960 a Genova, la città natale dove era ritornato nel 1935, amareggiato dalla mancata scoperta del florenzio e dalla polemica che ne era seguita. Noi possiamo ipotizzare che i campioni analizzati a Firenze da Rolla contenessero tracce minime dell’elemento 61; purtroppo i mezzi allora a disposizione non permisero di isolarlo. Rolla, come Mosè, giunse in vista della terra promessa senza potervi entrare.
Sopra un nuovo elemento: il Florenzio (numero atomico 61)
Presentata dal Socio Garbasso in plico suggellato nel giugno 1924 Il metodo di frazionamento basato sulla formazione dei solfati doppi del tallio, che aveva dato ottimi risultati nel caso delle terre dell’ ittrio e per la separazione del cerio, fu esteso agli elementi didimici.
Si partì da 400 gr di ossido di didimio commerciale proveniente da monazitedel Brasile e contenente tutte le terre ceriche e piccole quantità di gadolinio e terre termiche (ci fu fornito dalla ditta de Hoen). Gli ossidi trasformati in solfati, furono addizionati con Tl2SO4 e si ottenne un precipitato cristallino colorato in giallo per la presenza di solfato cerico. La soluzione soprastante fu cristallizzata sino ad ottenere altre 5 frazioni.
Le varie cristallizzazioni furono sciolte a freddo in acqua leggermente acida per H2SO4 e cristallizzata frazionatamene..
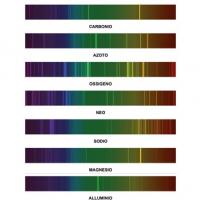
Durante il controllo del frazionamento, eseguito mediante gli spettri di assorbimento, abbiamo potuto osservare che le bande descritte come caratteristiche del neodimio si comportano diversamente cosicché, man mano che le frazioni di testa si arricchivano in praseodimio, mentre due bande aumentavano di intensità, due diventavano più deboli. Ciò fece supporre che si fosse di fronte ad un nuovo elemento che, ragionevolmente, dovrebbe appartenere al gruppo del cerio ed avere proprietà simili al neodimio e la samario.
Nel nostro caso come in altri simili, una prova diretta dell’esistenza del nuovo elemento poteva essere data da misure rongtenspettrografiche. Dobbiamo alla cortesia della Sig.na Brunetti, che si è valsa dei mezzi sperimentali dell’ Istituto di fisica di Arcetri, le spettrografie (che verranno riportate in una nota a parte) dalle quali risulta l’ elemento in questione.
Per questo elemento, di numero atomico 61, noi proponiamo il nome di Florenzio (Florentium) e il simbolo Fr. Lavoriamo attualmente sopra grandi masse di monazite allo scopo di separare questo elemento che in natura si trova in piccolissime quantità.. L’ essere scarso in natura spiega il risultato negativo a cui giunsero recentemente Gunther e Stranski i quali esaminarono rongtenspettrograficamente le frazioni sulle quali si erano concentrati gli elementi di numero atomico compreso fra 60 e 66.
Pertanto dalle ricerche di Hudding potrebbe sembrare che la fluocerite lo debba forse contenere.
FONTE Gazzetta Chimica Italiana del 1926, volume 56, pagine 862-863 ROLLA Luigi e FERNANDES Lorenzo – Ricerche sopra l’elemento di numero atomico 61: Florenzio
We propose the name of Illinium with symbol Il for this element in honor of the State of Illinois and of our University da J. Am. Chem. Soc., 48, 1597 (1926)
FONTE OSERVATIONS ON THE RARE EARTHS XXIII. ELEMENT NO. 61 PART TWO. X-RAY ANALYSIS by J. Allen Harris with L.F. Yntema and B.S.Hopkins
Le Terre Rare
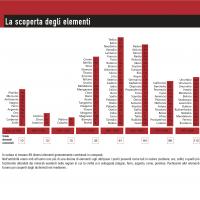
Nel 1787 un tenente dell’esercito svedese, C.A. ARRHENIUS, scoprì casualmente un campione di un insolito minerale nero in una cava di Ytterby, un paesino non lontano da Stoccolma.
Nel 1794 J. GADOLIN, un chimico finlandese dell’Università di Abo, separando da campioni del suddetto minerale il 38% circa di una nuova e non descritta “terra” (ossia “ossido” nella nostra terminologia) pose le basi, senza esserne completamente consapevole, ad una serie di studi che si estende ancora ai nostri giorni.
Nei successivi 13 anni vennero infatti avanzate un centinaio di rivendicazioni di scoperte di nuovi elementi del gruppo delle Terre Rare (TR). Ciò fu la conseguenza di tre fattori principali:
- la contemporanea presenza di più elementi nei minerali
- la stretta somiglianza del comportamento chimico delle TR che ne rende estremamente difficoltosa la separazione
- l’assenza di test analitici appropriati
Fu nel 1797 che A.G. EKEBERG di Uppsala propose il nome di gadolinite per il minerale scoperto da Arrhenius e quello di yttria per la nuova terra. Nel 1803 M.H. KLAPROTH e, indipendentemente, J.J. BERZELIUS, isolarono da un minerale pesante un’ altra terra simile ma non identica. Ad essa fu dato il nome di ceria ed al minerale quello di cerite. A quel tempo si riteneva che sia la yttria sia la ceria derivassero ciascuna da un solo elemento. Studi successivi mostrarono che ognuna di esse era una miscela complessa di ossidi. La separazione di questa miscela e l’individuazione degli elementi richiese più di un secolo di indagini e di tentativi.
Da un punto di vista teorico, nella Tavola Periodica era previsto un solo posto per le terre rare in quanto esse venivano considerate come “semplici modificazioni diversificate dello stesso elemento”. Si dovette attendere A. WERNER che nel 1905, nonostante non fosse stata ancora formulata una valida teoria atomica, propose una Tavola Periodica con 15 posti vacanti tra La e Hf.
Fu H.G.J. MOSELEY che, nel 1913, grazie alla nuova tecnica della spettroscopia a
Raggi X, dimostrò definitivamente che tra La ed Hf possono essere presenti soltanto 14 elementi.
E si deve infine a N. BOHR, nel 1918/21, un modello della teoria atomica che contempla la presenza di un quarto gruppo quantico (prima serie degli elettroni f). Si trattò di un lungo periodo di esperimenti condotti inizialmente praticamente alla cieca, complicati dall’impossibilità di comprendere perché queste sostanze fossero così simili e di valutare quante fossero le specie elementari in gioco.
La ricerca fu inoltre resa più complessa, almeno fino alla II guerra mondiale, dalla mancanza di mezzi sperimentali sicuri per l’identificazione assoluta di elementi in campioni supposti puri.
Anche se furono commessi errori, anche se nacque molta confusione, possiamo e dobbiamo riconoscere la perseveranza di una schiera di studiosi che riuscirono alla fine a risolvere uno dei più complicati fra tutti i problemi chimici.
L’analisi della ceria e della yttria
Il problema della separazione dei vari componenti di queste miscele fu particolarmente complesso.
Il procedimento di analisi
L’attacco dei minerali che, come la monazite e la gadolinite, non contengono nè niobio, nè tantalio, nè titanio si esegue riscaldandoli con acido solforico concentrato.
Dopo esaurimento e calcinazione si riprende con acqua fredda; la silice eventualmente presente rimane indisciolta e si separa per filtrazione. Dalla soluzione si eliminano, precipitandoli come solfuri, il rame, il bismuto ed il molibdeno; quindi si precipitano come ossalati le terre rare.
Nei minerali in cui sono presenti niobio, tantalio e titanio è necessaria la fusione con solfato acido di potassio; dopo aver ripreso con acqua, si tratta con ammoniaca la soluzione decantata. Per lunga ebollizione della soluzione nitrica del precipitato ottenuto con ammoniaca, e nel quale sono presenti il niobio, il tantalio, il titanio e le terre rare, si separano queste ultime mentre gli altri elementi restano nel residuo come TiO2, ZrSiO4, ecc.
L’operazione va ripetuta più volte dopo di che si precipitano dalla soluzione le terre rare come ossalati. Tali ossalati vanno quindi calcinati e trasformati in ossidi. La separazione degli ossidi delle terre rare, così ottenuti, è particolarmente problematica. Il metodo principale, impiegato anche in Italia nei laboratori delle Università di Firenze e di Genova, è stata la cristallizzazione frazionata. Solo nel secondo dopoguerra a questa tecnica subentrò quella che impiegava le resine a scambio ionico.
La cristallizzazione frazionata
La tecnica si attua su sali semplici, ad esempio i solfati, o su sali doppi, per esempio i nitrati doppi delle terre rare e di ammonio. La miscela da separare viene fatta cristallizzare a porzioni successive in modo da ottenere cinque o sei porzioni ed un’acqua madre corrispondente; si ottiene così una serie “A”.
La prima porzione della serie “A” si fa cristallizzare nuovamente e così si ottiene una frazione “1” della nuova serie “B” ed un’acqua madre; questa acqua madre si unisce alla porzione “2” della serie “A” e si fanno ricristallizzare assieme ottenendo così la porzione “2” della serie “B”.
L’acqua madre nuovamente ottenuta dà, con la porzione “3” della serie “A”, la porzione “3” della serie “B” e così via. Ripetendo queste serie, ognuna contiene una frazione di più della precedente e dopo un numero variabile di serie – spesso costituito da diverse migliaia - i termini estremi sono costituiti da prodotti puri.
Le capsule in porcellana, posizionate su opportuni supporti e riscaldate con fiamme bunsen, costituiscono i recipienti impiegati dagli operatori dell’Istituto di Chimica Generale, prima a Firenze e poi a Genova, per realizzare la separazione delle terre rare mediante la cristallizzazione frazionata di diversi sali.
Le resine a scambio ionico
Nel primo dopoguerra le tecniche di cristallizzazione frazionata furono sostituite da quelle che impiegano le resine a scambio ionico. Si deve al gruppo di ricercatori operanti nei laboratori di Oak Ridge sotto la direzione di G.E.Boyd e E.R. Thompson la prima pubblicazione (1947) che indicava la possibilità di separare una miscela di ioni tripositivi di lantanidi mediante l’eluizione con soluzioni di acido citrico.
Gli studi di F.H. Spedding e collaboratori, presso l’Università dello Iowa, contribuirono quindi, immediatamente dopo, alla messa a punto di tecniche di scambio ionico su scala macroscopica.
Presso l’Istituto di Chimica Generale a Genova, Luigi Mazza ed i suoi collaboratori negli anni ’50, misero a punto un impianto di colonne di resine a scambio ionico che permetteva la separazione di terre rare a livello di centinaia di grammi mediante eluizioni con soluzioni di acido citrico.
Nella foto è mostrato l’impianto che impiegava il metodo cosiddetto della “rampa inclinata” per la raccolta delle frazioni.
Il controllo analitico
Il controllo analitico delle frazioni separate per cristallizzazione frazionata o per scambio ionico veniva eseguito mediante la spettrofotometria UV-Visibile di assorbimento in soluzione, la spettroscopia di emissione e, in alcuni laboratori, con l’impiego dei raggi X.
Energia per la chimica
Per separare, purificare o trasformare le diverse sostanze occorre energia. Già nell’antichità sono stati inventati fornelli, forni, mantici ed altri sistemi per raggiungere le temperature necessarie a questi scopi bruciando legna, carbone, oli ed altri combustibili.
Questi sistemi sono stati via via modificati e perfezionati nel corso delle diverse civiltà succedutesi ma soltanto a partire dal ‘700 la rivoluzione scientifica ha portato sostanziali progressi ed innovazioni.
La scoperta della materia aeriforme nel giro di un secolo e mezzo di prove e ricerche ha portato alla produzione di gas e di loro miscele che permisero di ottenere anche temperature molto elevate. In particolare vennero prodotti gas adatti a fornire anche fiamme molto luminose e distribuibili a distanza a molteplici utenze.
Nel ‘700 elevate temperature su limitate porzioni del materiale in esame vennero ottenute grazie al cannello ferruminatorio oppure concentrando la radiazione solare con lenti e specchi di varie dimensioni.
Parallelamente la scoperta dell’elettricità e la realizzazione di potenti generatori elettrostatici portò un nuovo grande contributo allo sviluppo della scienza chimica che, alla fine del secolo, ebbe una radicale svolta innovativa con la costruzione della prima pila che favorì un rapidissimo sviluppo degli studi e della ricerca chimica.
Ciò segnò la nascita di una vera e propria disciplina, l’Elettrochimica, che permise di raggiungere nuovi traguardi non consentiti dalle tecniche già note, quali la scoperta di molti elementi e la messa a punto di peculiari operazioni chimiche.
Finalmente, dopo la metà dell’ottocento e lo sviluppo delle tecniche spettroscopiche, iniziarono i primi tentativi per utilizzare l’energia delle radiazioni elettromagnetiche in maniera più razionale e raffinata che non il mero riscaldamento.
Via via ciò portò alla definizione della moderna Fotochimica ed alle più recenti tecniche di apporti di energia selettivi e puntuali grazie all’impiego di laser con emissione a una data frequenza e con varia potenza.
I Raggi X
una scoperta rivoluzionaria di enorme impatto sull’opinione pubblica
Nella seconda metà dell’800 lo studio delle scariche elettriche nei gas era condotto in numerosi laboratori di ricerca e, nel 1879, Crookes scoprì i raggi catodici, fasci di (allora) misteriose particelle, deviabili con un magnete, rilasciati dal catodo in un tubo a bassa pressione.
Noi oggi sappiamo che i raggi catodici sono costituiti da elettroni e che essi provocano l’emissione di raggi-X quando colpiscono un qualsiasi materiale e, quindi, anche il vetro di un tubo di Crookes in funzione.
Tuttavia, per molti anni i ricercatori non sospettarono la presenza di queste radiazioni invisibili per l’occhio umano. Lo stesso Crookes contestò diverse forniture di lastre fotografiche ritenendo che gli aloni presenti su di esse fossero difetti di fabbricazione.
Invece essi erano stati originati dalle radiazioni emesse dal vetro dei suoi tubi catodici che, diversamente dalla luce, potevano attraversare le pareti degli astucci contenenti le lastre. L’esistenza di queste radiazioni fu scoperta soltanto dopo molti anni da Roentgen, uno scienziato particolarmente interessato allo studio di un altro tipo di radiazioni non percepibili dall’occhio umano: i raggi ultravioletti (UV). Per rivelare questi raggi egli utilizzava cristalli di bario platino cianuro, sostanza che emette luce visibile (violetta) quando colpita dalle radiazioni UV.
La sera del 8 novembre 1895, mentre stava effettuando esperimenti con un tubo di Crookes, Roentgen osservò che alcuni cristalli di bario platino cianuro, casualmente presenti sul tavolo del laboratorio, si illuminavano nonostante il tubo catodico stesso fosse stato accuratamente ricoperto con cartone nero per mascherare la fluorescenza propria del vetro. Sapendo che i raggi catodici non attraversano il vetro e che quelli UV non passano attraverso il cartone nero, Roentgen capì che il fenomeno doveva essere collegato ad un inedito tipo di radiazioni. Così egli, all’insaputa anche dei collaboratori più stretti, per sette settimane effettuò un gran numero di prove e di puntuali esperimenti per chiarirne il comportamento e le proprietà, utilizzando come rivelatori sia lastre fotografiche che schermi di bario platino cianuro.
Finalmente, il 28 dicembre 1895 a Wurtzburg in Germania, Roentgen presentò i risultati di questo intenso e dettagliato lavoro suscitando enorme interesse nel pubblico presente. Neppure un mese dopo, il 23 gennaio 1896 Nature pubblicò la traduzione inglese della comunicazione originale, presentata in tedesco, dove le misteriose radiazioni venivano indicate con il nome raggi X. In poche settimane la notizia fece il giro del mondo e nel maggio dello stesso anno esce la prima rivista specializzata sui raggi-X e loro applicazioni. Nel solo 1896, vengono stampati un migliaio di articoli su giornali e riviste ed una cinquantina di libri ed opuscoli concernenti i raggi-X e corredati da fotografie di oggetti e corpi opachi alla luce visibile.
L’impatto sull’opinione pubblica mondiale fu enorme e, grazie anche alla relativa semplicità delle apparecchiature necessarie per la loro produzione, l’utilizzo dei raggi-X si espanse a macchia d’olio al di là dei laboratori di fisica. Lo sviluppo delle applicazioni in campo medico fu immediato e già nell’ottobre 1896 la General Electric diffuse un catalogo di apparecchi per raggi-X adatti a questo tipo di impieghi. In breve tempo vennero anche testate le proprietà di fluorescenza ai raggi-X di almeno 2000 diverse sostanze ed il tungstato di bario risultò essere il materiale più efficiente per produrre schermi per la rivelazione dei raggi-x.
Nel marzo 1896 Roentgen pubblicò un secondo lavoro che illustrava gli effetti ionizzanti dei raggi-X sull’aria ed i gas (risultati interpretati dopo anni da Thomson) e proponeva miglioramenti delle apparecchiature necessarie per l’alimentazione dei tubi. Il terzo ed ultimo lavoro di Roentgen esce nel maggio 1897 e dimostra l’esistenza dei raggi-X secondari, ossia delle radiazioni generate da qualsiasi sostanza quando viene colpita con raggi-X. In esso vengono anche riportati i primi dati quantitativi sulla trasmissione dei raggi-X in funzione dello spessore di svariate sostanze.
Nel 1901 Roentgen riceve il Premio Nobel per la scoperta dei raggi-X. Successivamente sono stati assegnati altri 14 Premi Nobel per studi sull’impiego dei raggi-X:
- Nel settore Fisica vengono assegnati sei Premi tra il 1914 ed il 1927 ed uno nel 1981. Da sottolineare per gli sviluppi nei campi strutturistico e spettroscopico quelli del 1914 (Von Laue), 1915 (Bragg), 1917 (Barkla) e 1924 (Siegbahn).
- Nel settore Chimica il primo viene assegnato nel 1936 (Debye) per la determinazione di strutture molecolari ed altri cinque in seguito: 1962 (Perutz/Kendrew, struttura delle proteine globulari), 1964 (Hodgkin, strutture biochimiche), 1976 (Lipscomb, struttura dei borani), 1985 (Hauptman/Karle, sviluppo dei metodi per determinazione cristallografiche e 1988 (Deisenhofer/Huber/Hartmut, struttura dei centri fotosintetici).
- Nel settore Medicina uno è stato assegnato nel 1962 (Crick/Watson/Wilkins) per la determinazione della struttura degli acidi nucleici, e un secondo nel 1979 (Cormack/Hounsfield) per la tomografia computerizzata.
Il colore
Il colore è sensazione. Per secoli si è cercata una spiegazione, prima come proprietà della materia, poi come proprietà della luce. Young per primo l’ha cercata nella costituzione dell’uomo…… La scienza dei colori deve essere considerata essenzialmente come una scienza della mente
James Clerk Maxwell (1831)
L’occhio umano possiede generalmente tre tipi di recettori dei colori quindi ciascuna radiazione di una data lunghezza d’onda λ viene “vista” come l’insieme dei tre valori restituiti da ciascun recettore. Pertanto mescolando opportunamente tre diversi colori è possibile generare una molteplicità di terne di valori, ciascuna delle quali viene percepita come un singolo colore.
La radiazione che colpisce l’occhio può provenire direttamente da una sorgente luminosa oppure dopo essere stata riflessa da oggetti. Sono quindi possibili due diversi tipi di sintesi dei colori dette rispettivamente additiva e sottrattiva. Il bianco, il nero ed altri colori non corrispondono ad alcuna lunghezze d’onda dello spettro visibile e vengono detti acromatici.
Chevreul
Michel-Eugène Chevreul (1786-1889) contribuì allo sviluppo della chimica moderna in vari campi. Condusse studi fondamentali sulla saponifi cazione delle sostanze grasse e pose le basi dell’analisi chimica organica.
Inventò la candela stearica, scoprì lo zucchero del diabete, smascherò le pseudoscienze,…. Impresse, inoltre, una decisa svolta agli studi per la definizione di una teoria sui colori e la sua legge del contrasto simultaneo dei colori ebbe grande impatto anche nel campo dell’arte. Infl uenzò molti pittori e, sviluppando la tecnica della sintesi ottica ottenibile accostando piccoli punti di colore, infl uenzò diverse scuole artistiche quale quella dei Puntillisti.
Le dieci ruote di colori ideate da Chevreul costituiscono un sistema accurato per defi nire un colore e le sue diverse gradazioni dal chiaro allo scuro e rappresentano un capolavoro della chimica dei coloranti e delle tecniche di stampa.
Ogni ruota presenta 72 colori disposti in settori con 20 diverse sfumature che variano regolarmente lungo il raggio. In totale, quindi, una ruota contiene 1440 diversi colori ed i colori dei due settori contrapposti lungo ogni diametro risultano complementari.
Vi sono scienziati che, grazie a dosi fuori dall’ordinario di curiosità, intelligenza e applicazione, trasformano in oro ogni argomento che toccano. Il chimico francese Chevreul, in 102 anni di vita, unì a queste qualità anche parecchio tempo a disposizione
P. Bressan
Coloranti e pigmenti
Attorno alla metà del XIX secolo le notevoli quantità di catrame, sottoprodotto delle fabbriche di gas illuminante, divennero una preziosa fonte di materia prima per la nascente Chimica Organica che ha permesso la sintesi di numerosi nuovi composti e la delucidazione della loro struttura molecolare.
L’industria chimica nasce in questo contesto grazie alla forte domanda di coloranti ed i notevoli successi ottenuti in questo campo in breve tempo si estendono ad altri settori per produrre farmaci, fiammiferi, esplosivi ed un’ampia gamma di materiali.
Il primo colorante organico prodotto industrialmente fu il Malva, scoperto casualmente nel 1856 da William Perkin mentre cercava di sintetizzare il chinino, prezioso farmaco antimalarico. Pochi anni dopo viene realizzata la prima sintesi di prodotti, i coloranti all’alizarina, seguendo una vera e propria progettazione chimica, ossia attraverso deduzioni razionali da principi teorici.
Circoli cromatici di Chevreul
Chevreul nota che un materiale colorato in ROSSO, GIALLO, BLU, ARANCIO, VERDE E VIOLETTO può essere modificato solo in quattro modi
1 – con del BIANCO schiarendolo
2 – con del NERO scurendolo
3 – con un altro colore che ne cambia le proprietà senza
offuscarlo
4 – con un altro colore che ne cambia le proprietà e lo
offusca, sino a nero o grigio
Ne deriva una nomenclatura precisa e non ambigua:
1 – TONI del colore
2 – GAMMA dei toni dello stesso colore
3 – SFUMATURE (nuances)
4 – GAMMA DEPRESSA (rabattue)
tutto ciò può essere rappresentato da un insieme cromatico secondo una semisfera cromatica